
Comparaison de la méthode d’ATPmétrie
et la microbiologie traditionnelle
Il existe deux sortes de prélèvements
avec cet appareil :
On utilise les « stylos Hylite » composés de :
- Un stick échantillonneur permettant le prélèvement d’un certain volume d’échantillon. Celui-ci est garni d’un produit chimique destiné à extraire l’ATP.
- Une cuvette avec une solution destinée à la dilution de l’échantillon.
-
Une chambre à réactifs, scellée par
une feuille d’aluminium, contenant le mélange luciférine/luciférase.
L’ensemencement se déroule en plusieurs étapes :
1.
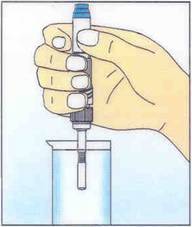
Retirer le stylo de son capuchon et
prolonger le stick échantillonneur dans un liquide à analyser. Les stries
doivent tremper entièrement dans ce liquide.

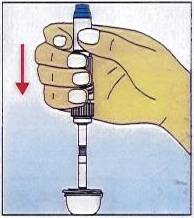
2.
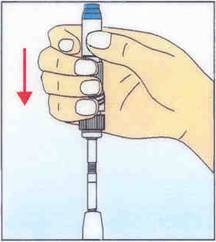
Placer le stick échantillonneur sur un
support dur et, en maintenant une pression constante, l’enfoncer dans le
compartiment en le maintenant à la verticale. A ce stade l’échantillon reste
stable 48 heures à température ambiante.
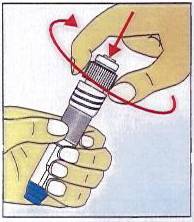
3.
Tourner en forçant dans le sens des
aiguilles d’une montre la partie supérieure du stylo contre la partie inférieure
de celui-ci. La chambre des réactifs est ainsi ouverte et
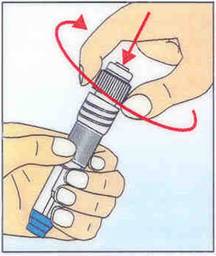
permet à la luciférine/luciférase d’être libérée.
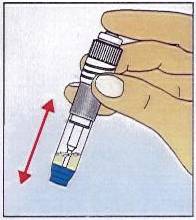
4.
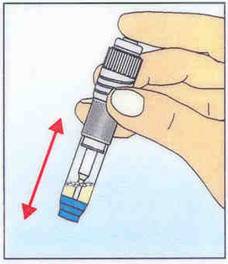
Afin de bien mélanger les réactifs,
secouer le stylo énergiquement au minimum dix fois ; il doit apparaître
une coloration jaune avec formation de mousse.
Les frottis seront réalisés à l’embouteillage et sur les bouteilles sorties de la laveuse. Pour ce type de prélèvements on utilise des écouvillons « Hylite » et une solution de rinçage « hylite » contenue dans le capuchon du stylo.
Pour le prélèvement :
-Retirer l’écouvillon de l’étui et l’humidifier dans la solution de rinçage.
-Frotter une
surface tout en tournant l’écouvillon dans les deux sens. Remettre l’écouvillon
dans son étui jusqu’à son analyse.


Au laboratoire, les stylos utilisés sont pratiquement les mêmes que pour les prélèvements liquides ; ils contiennent en plus une solution de rinçage qui permet d’humidifier l’écouvillon.
L’ensemencement se déroule en plusieurs étapes :
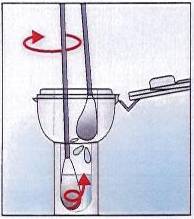
6.
.Introduire l’échantillonneur dans la
chambre de mesure du Hylite2 et litre le résultat en ULR sur l’écran.
Le but de cette
technique est de filtrer un liquide (bière ou eau de tanks lavés) sur un
« filtre à membrane » stérile pour la recherche de bactéries
et/ou levures.
Mode opératoire :
.
(voir photos en annexe)
Ce sont toutes les bactéries qui se développent dans le produit à tous les stades de la fabrication et qui provoquent un goût, un aspect indésirable, une odeur à la bière.
1.Voile – trouble.
Ce voile ou trouble devient visible en présence d’un grand nombre de bactéries.
2.Viscosité
Cette viscosité peut aller jusqu’à un aspect huileux.
3. « Faux goûts » :
- Acide : Certaines bactéries transforment les hydrates de carbone en de nombreux acides(lactique, acétique, succinique)
- Diacétyle : Provoqué par les bactéries lactiques et donnent un goût de beurre.
- Autres faux goûts : Céleri, cidre, pourriture, pomme.
1.Lactobacillus :
-
Peuvent être responsables d’acidités.
-
Peuvent hydrolyser les dextrines et l’amidon en sucres
fermentescibles, ce qui résultera en une super atténuation du moût.
- Ils forment l’acidité, trouble, viscosité et odeurs désagréables dans la bière.
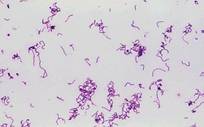

 2.Pédiocoques :
2.Pédiocoques :
-
Forment du dyacétyle et de l’acide lactique dans la bière.
-
Responsables de viscosité.
3.Acétobacter, Pseudomonas :
-
Produisent l’acidité.
-
Confèrent un voile trouble.
- Acétobacter sont des oxydants puissants.
4.Zymononas :
-
Produit de l’acétaldéhyde et du H2S qui confèrent à la
bière un goût de pomme pourrie.
-
Il forme un trouble soyeux et augmente la viscosité.
5.Pectinatus :
- On retrouve généralement le pectinatus dans les bières à faible teneur en alcool.
6.Entérobactérie :
-
Diminue la vitesse de fermentation.
- Produit des goûts fruités (ces faux goûts peuvent persister jusque dans le produit final).

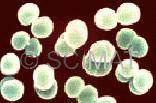
Une levure
sauvage peut être définie comme une levure que l’on n’emploie pas délibérément,
en d’autres termes, toute levure de race autre que celle de la levure de
culture utilisée pour la fermentation.
Toutes les
levures sauvages ne détériorent pas la bière, mais leur présence est un
signe de contamination.
1.Trouble :
Le trouble peut
avoir son origine dans la croissance de levures sauvages restant après
filtration.
2.Formation d’une pellicule en surface :
En présence
d’air, les levures qui forment un film peuvent se multiplier très rapidement
et provoquer un trouble.
3. « Faux goûts » :
Les faux goûts
peuvent prévenir du métabolisme de toutes les levures sauvages.
4.Super atténuation :
Saccharomyces
diastaticus provoquent une infection dangereuse.
Outre le fait
qu’elle génère un trouble et un faux goût, elle peut fermenter l’amidon
et les dextrines, en conduisant à une atténuation anormale de la bière.
Les milieux de
culture utilisés au laboratoire de la brasserie Jupiler sont les suivants :
NUTRIMENT, MG, WL, WLD, MRS et MSP. Pour plus de renseignements sur l’origine,
la composition, la préparation de ces milieux et tableaux voir l’annexe.
1.M.G.
Nom :
Mout Gélosé.
Consistance :
Milieu solide.
Incubation :
3 jours en anaérobiose.
Utilisation :
contrôle du moût, de la bière à la sortie des filtres, en canetterie, au
soutirage fûts et à l’embouteillage.
Microorganismes
détectés : bactéries
anaérobies et levures (de culture ou sauvages).
2.M.R.S.
Nom :
Milieu de Man, Rogosa et Sharpe.
Consistance :
Milieu solide.
Incubation :
8 jours en anaérobiose
Utilisation :
contrôle de la bière à la sortie des filtres, en canetterie, au soutirage fûts
et à l’embouteillage.
Microorganismes
détectés : bactéries
lactiques (Pediococcus, Lactobacillus).
3.M.S.P.
Nom :
Milieu Spécial.
Consistance :
Milieu liquide.
Incubation :
21 jours en anaérobiose.
Utilisation :
contrôle du moût, de la bière à l’entrée et à la sortie des filtres et
aussi la bière en garde.
Microorganismes
détectés : bactéries
lactiques
4.NUTRIMENT.
Nom :
Nutriment Agar.
Consistance :
Milieu solide.
Incubation :
3 jours en anaérobiose.
Utilisation :
contrôle des eaux.
Microorganismes
détectés : microflore
totale de l’eau.
5.W.L.
Nom :
Wallerstein Laboratories Nutriment medium.
Consistance :
Milieu solide.
Incubation :
3 jours en aérobiose.
Utilisation :
contrôle des frottis de soutireuses et des bacs à désinfectants.
Microorganismes
détectés : bactéries
aérobies et levures (de culture ou sauvage).
6.W.L.D.
Nom :
Wallerstein Laboratories Différential medium.
Consistance :
Milieu solide.
Incubation :
3 jours en aérobiose.
Utilisation :
contrôle de la bière en garde et en traversage.
Microorganismes
détectés : bactéries
aérobies.
J’ai effectué
des prélèvements hylite et micro sur la chaîne de fabrication. Il y a trois
groupes de production que l’on inspecte chaque lundi. Voici les résultats de
mes prélèvements.
|
|
|
Micro |
Hylite2 |
|
Groupe1.1. |
E.I. |
0 |
430 |
|
|
I |
0 |
11 |
|
|
I' |
40 |
2500 |
|
|
T |
0 |
180 |
|
|
T' |
0 |
14 |
|
|
C |
0 |
61 |
|
|
C' |
0 |
14 |
|
|
G |
0 |
10 |
|
|
|
Micro |
Hylite2 |
|
Groupe
1.2. |
E.I. |
0 |
15 |
|
|
I |
0 |
32 |
|
|
I' |
0 |
12 |
|
|
T |
0 |
44 |
|
|
T' |
0 |
10 |
|
|
C |
0 |
6 |
|
|
C' |
0 |
9 |
|
|
G |
0 |
14 |
|
|
|
Micro |
Hylite2 |
|
Groupe
3.1. |
E.I. |
0 |
14 |
|
|
I |
0 |
11 |
|
|
I' |
0 |
20 |
|
|
T |
20 |
580 |
|
|
T' |
0 |
11 |
|
|
C |
0 |
10 |
|
|
C' |
0 |
38 |
|
|
G |
0 |
16 |
|
|
|
Micro |
Hylite2 |
|
Groupe
3.2. |
E.I. |
0 |
5 |
|
|
I |
0 |
4 |
|
|
I' |
0 |
20 |
|
|
T |
0 |
16 |
|
|
T' |
0 |
16 |
|
|
C |
0 |
11 |
|
|
C' |
0 |
10 |
|
|
G |
0 |
6 |
|
|
|
Micro |
Hylite2 |
|
Groupe
2. |
E.I. |
0 |
19 |
|
|
I |
0 |
9 |
|
|
I' |
0 |
10 |
|
|
T |
0 |
14 |
|
|
T' |
0 |
18 |
|
|
B |
0 |
60 |
|
|
B' |
0 |
190 |
|
|
G |
0 |
120 |
Lors de ces
tests, nous pouvons remarquer que les résultats Hylite sont plus élevés que
ceux de la Micro. Ce qui est logique car les résidus de bière contiennent de
l’ATP. Nous avons voulu savoir s’il existait un rapport entre la
microbiologie traditionnelle, utilisée en brasserie, et l’ATPmétrie. Pour ce
faire, nous avons parallèlement à un test Hylite, réalisé un contrôle
microbiologique dans les conditions de travail habituelles. Généralement, on
utilisait des milieux dit sélectifs, tandis que l’appareil détecte toute
sorte de microorganisme sans exception. Nous en avons déduit qu ‘il
n’y avait aucun liens entre ces deux méthodes.
La seule chose
que l’on peut affirmer est que lorsque l’on atteint une valeur supérieure
à 2000 ULR, on est certain d’être positif en microbiologie.
Feuilles
en annexe :
1. Filtrer le
moût houblonné.
2. Ajouter 8g
d’agar.
3. Ajouter 8mg
de bromocrésol.
4. Chauffer au
micro-ondes, jusqu’à dissolution complète.
5. Stériliser
à l’autoclave (40 minutes).
1 .Peser 28g de
M.R.S. Agar :
Formule :
Peptone
10g/L
Extrait de bœuf
10g/L
Extrait de
levures
5g/L
Dextrose
20g/L
Tween 80
1g/L
Citrate d’ammonium
2g/L
Acétate de sodium
5g/L
Sulfate de magnésium
0.1g/L
Sulfate de
manganèse
0.05g/L
Phosphate
dipotassique
2g/L
Agar
15g/L
2. Ajouter 16ml
de moût non houblonné, bouilli et filtré.
3. Ajouter
200ml de triple (bière Piedboeuf)
4. Ajouter
200ml d’eau déminéralisée.
5. Ajouter 8mg
d’actidione.
6. Dissoudre au
micro-onde et auto claver 40 minutes.
1. Dans 5
litres de moût non houblonné :
-250g de
Peptonized milk.
-2.5g de
Sulfate de manganèse.
-0.5g de
dihydrogènophosphate de potassium.
-50g de
maltose.
-1g d’extrait
de levure.
Mettre une nuit
au frigo (éviter de faire mousser la bière).
2. Verser le
tout dans un fût de Jupiler (ayant passé la nuit au frigo) à l’aide d’un
entonnoir spécial permettant d’évacuer le surplus de bière.
Ajouter 20ml
d’eau distillée contenant 3g d’acide ascorbique et 1g d’actidione.
Ajouter 13ml de
NH3.
3. Dissoudre au
micro-onde et auto claver 40 minutes.
1.Peser 9.2g de
Nutriment Agar
Formule :
Extrait de bœuf :
3g/L.
Peptine :
5g/L.
Agar :
15g/L
2. Ajouter de
l’eau déminéralisée jusqu’à 400ml.
3. Dissoudre au
micro-onde et auto claver 40 minutes.
1.Peser 32g de
W.L.N
Formule :
Glucose
20g/L
KH2PO4
0.55g/L
KCl
0.425g/L
CaCl2.2H2O
0.125g/L
MgSO4.7H2O
0.125g/L
MnSO4.4H2O
2.5g/L
FeCl3.
H2O
2.5g/L
Hydroxylat de
caséine 5g/L
Extrait de
levure
4g/L
Vert de bromocrésol
22mg/L
Agar
20g/L
2. Ajouter de
l’eau distillée jusqu’à 400ml.
3. Dissoudre au
micro-onde et autoclaver 40 minutes.
1. Peser 32g de W.L.D.
Formule :
La composition
de ce milieu est identique au W.L.N., elle contient seulement 0.004g/L
d’actidione en plus.
2. Ajouter de
l’eau déminéralisée jusqu’à 400ml.
3. Dissoudre au
micro-onde et autoclaver 40 minutes.
- Bibliothèque Interbrew Jupille : documentation générale.
- Hylite 2 : Manuel d’utilisation, firme MERKS 2000.
- GIRARD S. ; Guide de la bière et de ses à cotés, Ed Temps Actuels, 1983.
- http ://www. Interbrew. be
-
http ://www.chez.com/microbiologie/lessivage.htm
- La Fabrication de la bière : Brasserie Piedboeuf, Jupille-sur-Meuse, 1985.
- GIRARD S. ; Etude HACCP et contrôle de qualité physico-chimique et microbiologique, Université de Bourgogne Dijon, Maîtrise 1999-2000.
Remerciements :
Je voudrais
remercier monsieur Pierre Nihoul (chef de labo) qui m’a permis d’effectuer
mon stage chez Interbrew, messieurs Luc Martin (Maître de stage), Joseph
Langner et Frédéric Mathijsen (Laborantins) qui m’ont énormément appris
tout au long de mon stage. Et surtout les responsables de ma section qui ont
ouvert une section fantastique.